Hialuronato de sodio para uso farmacéutico
-

-
Calidad estable y alta pureza logrados a través de la fabricación integrada en Japón.
El hialuronato de sodio para uso farmacéutico cumple con los requisitos regulatorios mundiales
Fabricación integrada en nuestra fábrica en Japón

Fermentación microbiana, no animal, no modificada genéticamente

Polímero extracelular derivado de “Streptococcus zooepidemicus”, un tipo de bacteria del ácido láctico, y por ende.
Cumplimiento de requisitos regulatorios mundiales
El hialuronato de sodio cumple con los requisitos regulatorios mundiales y es un ingrediente activo muy apreciado en mercados de Europa, EE.UU., Japón, Corea del Sur e India.
Se ajusta a las normas oficiales de los siguientes países y regiones, y ha obtenido registros farmacéuticos y licencias comerciales.
Información de registros farmacéuticos y licencias comerciales por país y región
| País/región | Registro farmacéutico / licencia comercial | Ente regulatorio |
|---|---|---|
| Unión Europea | Certificate of Suitability to the European Pharmacopoeia | EDQM |
| Estados Unidos | Drug Master File for US FDA | FDA |
| Corea Sur | Drug Master File | MFDS |
| India | API Registration Certificate | CDSCO |
| Japón |
Master file |
PMDA |
Cumplimiento de estándares oficiales de farmacopea por país y región
| European Pharmacopoeia | Sodium Hyaluronate |
|---|---|
| Japanese Pharmacopoeia | Purified Sodium Hyaluronate |
Certificado como Halal

Ofrecemos hialuronato de sodio producido por fermentación microbiana. Está certificado como Halal (JAKIM Malasia) por la Asociación Musulmana de Japón (JMA).
Varias variaciones de peso molecular (viscosidad) están disponibles y se pueden aplicar a varias formulaciones
Disponible en una amplia gama de pesos moleculares y viscosidades, desde moléculas pesadas a ligeras, y de viscosidad alta a baja. Como resultado, se puede aplicar a una variedad de formulaciones farmacéuticas (FDF).
|
Product Name |
SODIUM HYALURONATE | |||||
|---|---|---|---|---|---|---|
| Pharma Grade 80 | GS-40 | GS-100 | GS-120 | GS-200 | GS-300 | |
| Intrinsic Viscosity (m3/kg) |
1.55–2.00 | 0.39-0.99 | 1.00–2.49 | 1.5-2.0 | 2.50–3.31 | 3.32-4.60 |
| Shelf Life | 3 Years* | 2 Years* | 3 Years* | |||
| Storage Conditions | 2 to 8℃ | -25 to -15℃ | ||||
| Packaging | 100g | 100g, 200g | 100g | |||
| Bacterial Endotoxins (EU/g) |
Not more than 2.5** | Not more than 40** |
Less than 50** | Not more than 40** | Less than 50** | |
Las cifras anteriores son solo de referencia. Por favor, pida las especificaciones oficiales.
Además, no todos nuestras especificaciones coinciden con todos los tipos de registros farmacéuticos (MF, etc.) a la vez.
Si es necesario, los contratos GQP pueden ser aceptados dentro del alcance.
* El período de garantía se basa en la viscosidad máxima (I.V.) en el momento de la fabricación de cada grado.
**El estándar EP es inferior a 0,05 (UE/MG).
Se puede utilizar como compuesto activo (API) o excipiente en productos farmacéuticos y dispositivos médicos
-
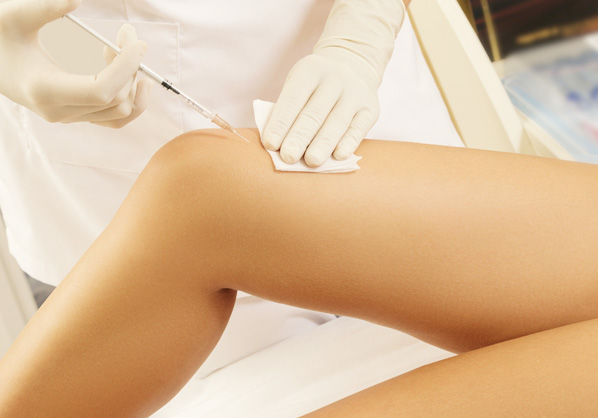
Inyección articular
Inyección de rodilla
(osteoartritis, artritis reumatoide) /
tratamiento de regeneración ósea -
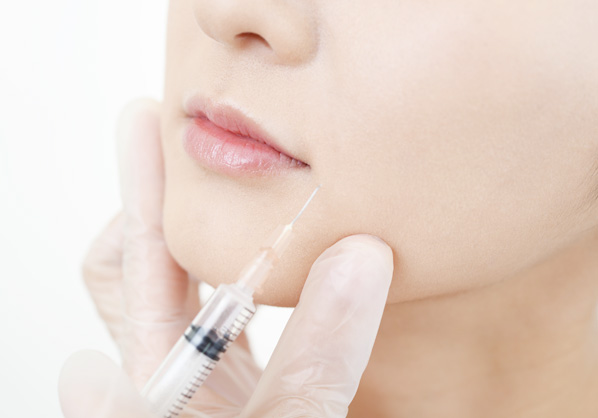
Cirugía cosmética
Relleno de piel / contorno /
formación de líneas corporales -
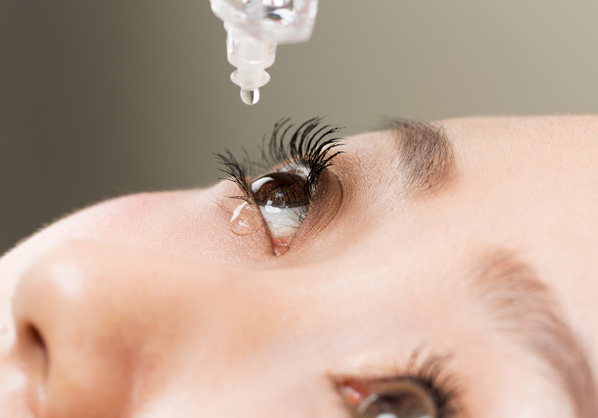
Oftalmología
Agente viscosa ocular (OVD) / gotas para los ojos /
productos para el cuidado de lentes de contacto /
dispositivo de inserción de lentes intraoculares -

Uso externo
Cuidado tópico de la piel /
uso tópico dermal / uso en heridas dermales -
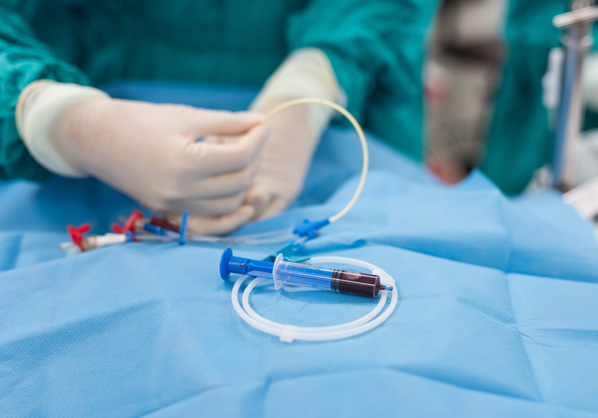
Equipo médico
Endoscopia, recubrimiento del catéter /
antiadherencia /
tratamiento del reflujo vesicureterico /
mucosectomía colorrectal (EMR)
Consultar
Si usted está interesado, por favor no dude en contactar con nosotros, incluyendo las solicitudes de catálogos, especificaciones, SDS, y muestras.
